Presión
¿Te has preguntado alguna vez porqué nadie bucea con un tubo de cinco, diez, o treinta metros de largo? La respuesta es obvia en cuanto intentas respirar a través de un tubo estando a más de un metro de profundidad bajo el agua. Si lo has probado alguna vez, debes saber que se convierte en extremadamente difícil inspirar en estas circunstancias. Esto es así porqué como más profundo estás, mayor es la presión. Piensa en la presión como en una fuerza que te empuja en todas las direcciones. A nivel del mar, estamos expuestos a una presión de 1,03 kilogramos por centímetro cuadrado (kg/cm2). Esto significa que cada centímetro cuadrado de tu cuerpo está presionado por una fuerza equivalente a 1,03 kilogramos. El origen de esta presión es en realidad consecuencia del peso del aire de la atmósfera de la Tierra. Como todos los gases, el aire de nuestro alrededor está compuesto de moléculas de distintos gases; en este caso, alrededor del 21% de estas moléculas son de oxígeno, aproximadamente el 78% de nitrógeno, y el resto está compuesto de un surtido de trazas de otros gases. Estas moléculas de gas tienen peso, lo que significa que la gravedad las está atrayendo hacia la Tierra. Como se puede imaginar, si coges una columna de aire, de un centímetro cuadrado de sección transversal, que se extiende desde el nivel del mar hasta el final de la atmósfera, todas las moléculas de gas de esta columna de aire tendrían tener un peso conjunto de aproximadamente 1,03 kg -- que nos lleva a los 1,03 kg/cm2 de presión a nivel del mar. Por conveniencia, los físicos han definido la "atmósfera" (abreviado ATM) como unidad de medida de presión igual a la presión causada por la atmósfera de la Tierra a nivel del mar (1,03 kg/cm2).
Como el aire, el agua causa presión con su peso. Pero por supuesto, el agua es considerablemente más densa (e.d. más pesada por un volumen dado) que el aire. Como se sabe, una columna de agua de un centímetro de sección transversal solo necesita tener 10 metros de alto para pesar 1,03 kg. Por lo tanto, a una profundidad de 10 m por debajo de la superficie, la presión ambiente total es de aproximadamente 2,06 kg/cm2, o 2 ATM -- 1 ATM a causa del peso del aire en la atmósfera de la Terra, más 1 ATM por el peso de los 10 metros de agua de mar. Para evitar confusiones, cuando la gente habla de presión bajo el agua, la unidad "ATA" ( que hace referencia a "atmósferas absolutas") se usa frecuentemente para representar la presión absoluta total causada tanto por el agua como por el aire por encima del agua.
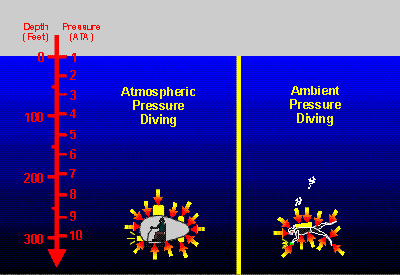
Tal como se muestra en el esquema de la derecha, la presión ambiente aumenta bajo el agua de forma prácticamente lineal en relación con la profundidad * . Por cada 10 metros (33 pies) de profundidad en agua de mar, la presión ambiente aumenta en 1,03 kg/cm2 (1 atm) adicionales. A una profundidad de 30 metros (99 pies), la presión ambiente es de 4 ATA -- una ATM causada por la atmósfera de la Tierra, más 3 ATM por cada 10 metros (33 pies) de profundidad --. De la misma manera, la presión ambiente a 90 metros (99 pies) por debajo de la superficie es de 10 ATA. El problema con la idea del larguísimo tubo es que los músculos que utilizamos para expandir y contraer nuestros pulmones durante la respiración no son suficientemente fuertes como para vencer tanta presión. Incluso unos pocos metros por debajo de la superficie, la presión es suficientemente alta para que no podamos expandir nuestros pulmones venciendo la presión del agua para inspirar una bocanada de aire de la superficie. Sencillamente, nuestros cuerpos no están diseñados para hacer esto.
Una manera de superar este problema es proteger el cuerpo del buceador de la presión ambiente. Las tecnologías de "Buceo a Presión Atmosférica", de las cuales las más familiares son los sumergibles de profundidad, hacen exactamente esto. La presión en el interior del sumergible se mantiene a 1 ATA - la misma presión que experimentamos en la superficie del mar. Bajo el agua, el incremento de la presión ambiente actúa sobre el casco del sumergible y no en el buceador de su interior. Por lo tanto, la persona en el interior del sumergible está siempre protegida de la presión ambiente y no tiene dificultad para respirar.
Otra manera de superar el problema de respirar bajo presión es suministrar una mezcla de gases presurizada al buceador. Si el gas es suministrado a la misma presión que la presión ambiente, los pulmones del buceador no deben trabajar contrarrestando la presión del agua (e.d., la presión del agua de alrededor y la presión del gas inspirado que se suministra están en equilibrio). Sin embargo, cuando se usa este tipo de tecnología de "Buceo a Presión Ambiente", el cuerpo del buceador está directamente expuesto a la presión ambiente. Y lo que es más importante, el gas inspirado en los pulmones del buceador está presurizado. Para entender las ramificaciones fisiológicas de esto, es importante entender los efectos del incremento de la presión en los gases.
Tal como ya hemos mencionado, el gas está compuesto de moléculas. A medida que aumenta la presión del gas, estas moléculas (que están en movimiento constante) quedan más concentradas. A una presión superior, un número prefijado de moléculas ocuparán un volumen menor ( o un determinado volumen estará ocupado por un numero mayor de moléculas). Por ejemplo, si tienes un globo relleno de gas en superficie, y luego este globo es sumergido bajo el agua, el globo se encogerá. De hecho, si llevas el globo a una profundidad de 10 metros (33 pies), se contraerá a la mitad de lo que ocupaba en la superficie. A 20 metros (66 pies) ocupará una tercera parte que en la superficie; a 30 metros (99 pies) una cuarta parte, y así sucesivamente. Si, a una profundidad de 30 metros (99 pies), quisieras expandir el globo a su tamaño original, lo tendrías que rellenar con cuatro veces más de moléculas de las necesarias en superficie. El devolver el globo rellenado a la superficie haría que aumentara por cuatro su tamaño original. No hace falta tener mucha imaginación para pensar lo que le podría ocurrir a los pulmones de un buceador si realizara una profunda inspiración en profundidad, y lo retuviera mientras asciende hacia la superficie. Este es el motivo por el que la regla de oro del buceador es "nunca retengas la respiración". La gente que olvida esta regla (por ejemplo, en un estado de pánico), corre el riesgo de sufrir un roturas en los pulmones, permitiendo la entrada directa de burbujas de gas en la sangre. Esto se llama embolismo, y puede provocar serios síntomas llegando hasta la parálisis e incluso la muerte
Un punto crucial aquí para entender otros aspectos de la física y de la fisiología del buceo, es darse cuenta que como mayor es la presión, más densamente apelotonadas (e.d., más altamente concentradas) están las moléculas del gas
* Nota : Como el agua es ligeramente comprimible, la relación entre profundidad y presión no es exactamente lineal a lo largo de todo el recorrido hasta el fondo; sin embargo para los propósitos de la tecnología del buceo, la desviación respecto a esta relación lineal es insignificante.
Para entender las ramificaciones fisiológicas de respirar varias mezclas de gases bajo presión, es útil entender el concepto de presión parcial. La presión parcial de uno de los gases que componen una mezcla de gases es una representación de la porción de la presión total de la mezcla de gases de este gas en particular. Si sumas todas las presiones parciales de los diversos gases que componen una mezcla, esta suma será igual a la presión total de la mezcla. Por confuso que esto pueda parecer, las presiones parciales son bastante fáciles de calcular: todo lo que necesitas saber es la fracción de cada uno de los gases que componente la mezcla, y la presión total de la mezcla.
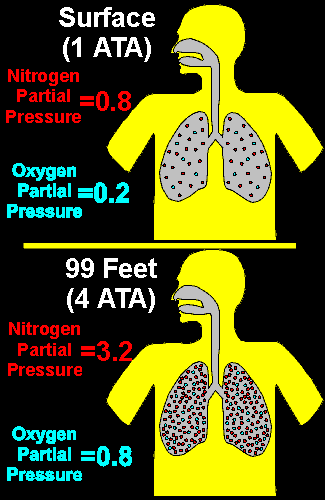
Por ejemplo, considera una persona respirando aire (una mezcla de gases que contiene aproximadamente 80% de nitrógeno y 20% de oxígeno) a nivel del mar. Tal como hemos dicho anteriormente, la presión ambiente a nivel del mar es de 1 ATA. Por lo tanto, la presión del aire que respira la persona es también de 1 ATA. Para obtener la presión parcial del nitrógeno del aire inspirado, multiplica simplemente la fracción de nitrógeno de la mezcla respirada (80%) por la presión total (1 ATA), lo cual da una presión parcial de nitrógeno de 0,8 ATA. Análogamente, multiplicando 20% de oxígeno por 1 ATA obtenemos una presión parcial de oxígeno de 0,2 ATA. Piensa ahora que ocurre cuando esta misma persona desciende a una profundidad de 30 metros (99 pies), donde la presión ambiente es de 4 ATA. Para que esta persona pueda respirar, la presión del aire inspirado debe ser igual a la presión ambiente. Por lo tanto, la presión parcial del nitrógeno inspirado es 80% por 4 ATA, es decir 3,2 ATA. La presión parcial de oxígeno es 20% por 4 ATA, es decir 0,8 ATA. A 30 metros (99 pies), la presión ambiente es 4 veces superior a la de la superficie, y la presión parcial de cada uno de los gases es también cuatro veces superior (aunque los porcentajes de cada gas sean los mismos en ambos casos). Como hemos dicho antes, las moléculas de gas están más estrechamente empaquetadas cuando están bajo presión; a una profundidad de 30 metros (99 pies), hay cuatro veces más de moléculas de gas (tanto de nitrógeno como de oxígeno) en un pulmón lleno de aire de las que hay en superficie. Una forma más sencilla de pensar en la presión parcial de los gases es considerar que la presión parcial representa un concentración absoluta de este gas, sin tener en cuenta la profundidad o la presión. Si una persona a respirado en superficie una mezcla de gases que contiene 80% de oxígeno, la presión parcial del oxígeno seria 0,8 ATA, que es exactamente la misma presión parcial de oxígeno cuando se respira aire a una profundidad de 30 metros (99 pies). En ambos casos (80% de oxígeno en superficie o aire a 30 metros/99 pies), la concentración de moléculas de oxígeno en los pulmones (e.d., el número total de moléculas de oxígeno en los pulmones en cada inspiración) es la misma.
Solo un apunte sobre notación: en su forma gaseosa, tanto el oxígeno como el nitrógeno son moléculas binarias; es decir, que los átomos se juntan por pares. Una molécula de oxígeno gaseoso consiste en dos átomos juntos de oxígeno, y una molécula de nitrógeno gaseoso de dos átomos juntos de nitrógeno. El símbolo para representar el oxígeno es "O", con lo que el oxígeno se representa como "O2"; el subíndice "2" indicando que se trata de dos átomos. Análogamente, el nitrógeno gaseoso está representado por "N2", y el dióxido de carbono por "CO2". Cuando se trata de presiones parciales de gases, la notación del gas se prefija con la letra mayúscula "P". Así, la "presión parcial de oxígeno" se escribe "PO2", y la "presión parcial de nitrógeno" se escribe "PN2".
La Ley de Henry establece que "La cantidad de un gas cualquiera que se disuelve en un líquido a una temperatura dada es función de la presión parcial de este gas en contacto con el líquido...". Para los buceadores esto significa que las moléculas de gas que se disolverán en la sangre es proporcional a la presión parcial de este gas en los pulmones (como todo ser de "sangre-caliente", nuestra temperatura corpórea se mantiene relativamente constante).
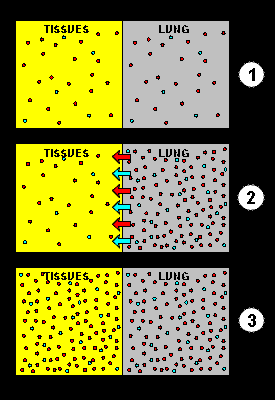
En el esquema de la derecha, la figura superior (1) representa una aproximación a la interfase entre los pulmones, la sangre y los tejidos de un buceador. A nivel del mar, los gases disueltos en la sangre y los tejidos son proporcionales a las presiones parciales de estos gases en los pulmones de esta persona en superficie. Al descender el buceador bajo el agua, la presión ambiente aumenta, y por lo tanto la presión de los gases en los pulmones aumenta proporcionalmente. Como ahora las presiones parciales de los gases en los pulmones son superiores que las presiones parciales de los gases en la sangre y en los tejidos, las moléculas de gas empiezan a desplazarse de los pulmones a la sangre y a los tejidos (representadas por las flechas azules y rojas en la figura del medio, 2). Finalmente, la concentración de los gases disueltos en la sangre y los tejidos se equilibrará con las presiones parciales de los gases que respira (e.d., un estado de equilibrio).
Las complejidades fisiológicas del "Buceo a Presión Ambiente" son consecuencia directa de los efectos de estos aumentos de las concentraciones de gases disueltos en la sangre y en los tejidos, y de como estas concentraciones aumentadas afectan a la forma en que trabaja nuestro cuerpo.
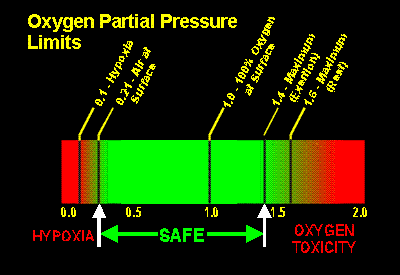
El oxígeno es el único gas que realmente necesitamos para respirar con el objeto de mantenernos vivos. Si no respiramos oxígeno (o si no respiramos suficiente oxígeno), morimos enseguida. Curiosamente, demasiado oxígeno puede ser malo también. A la derecha hay un esquema que ilustra el rango de las concentraciones de oxígeno que podemos respirar sin tener problemas. Las franjas verdes y rojas representan una escala de presiones parciales de oxígeno inspirado (PO2), que van desde cero de oxígeno a la izquierda, hasta una (PO2) de 2,0 ATA a la derecha. A través de la evolución, nuestros cuerpos se han optimizado para respirar oxígeno a una presión parcial (PO2) de 0,21 ATA. Si el PO2 inspirado es mucho menor que esto, nuestros cuerpos empiezan a apagarse -- llegando a la inconsciencia cuando la PO2 cae por debajo de 0,1 ATA aproximadamente (e.d., 10% de oxígeno a nivel del mar). A esto se le llama hipoxia. Respirar más de 0,21 ATA es en general bueno ... hasta un determinado punto. Si la PO2 inspirada se mantiene por encima de 0,5 ATA durante largos periodos de tiempo (de varias horas a días), la gente empieza a sufrir lo que se suele llamar toxicidad por oxígeno "pulmonar" o "crónica". Sus efectos incluyen sensación de quemazón o irritación en los pulmones, y puede afectar a la respiración. Excepto para las personas que se están varios días seguidos bajo presión (p.e., los buceadores profesionales en las plataformas petrolíferas), esta forma de toxicidad por oxígeno no se llega a presentar en los buceadores.
Sin embargo, a la que la PO2 sube por encima de 1,2 a 1,4 ATA aproximadamente, otro tipo de toxicidad por oxígeno, llamado "CNS" ("Sistema Nervioso Central" / "Central Nervous System") o toxicidad por oxígeno "aguda", se convierte en un problema relevante. Aunque varios síntoma sutiles como contracciones musculares en la cara y visión de túnel hayan sido atribuidos a este tipo de toxicidad por oxígeno, el síntoma realmente importante es grave, convulsiones descontroladas. A pesar de que estas convulsiones no parecen causar ningún tipo de lesión permanente de por sí, el problema para un buceador que experimente este tipo de convulsiones, es la obvia dificultad de mantener el regulador en su boca. Más de un buceador se ha ahogado bajo el agua como consecuencia aparente de las convulsiones inducidas por oxígeno. Esta es quizá la más seria e insidiosa de las enfermedades del buceo, porque aparece de forma impredecible y sin avisar, y generalmente provoca la muerte del buceador afectado.
No se conoce con exactitud el proceso bioquímico implicado en la toxicidad por oxígeno CNS, ni tampoco existe consenso en cual es el límite superior de PO2 seguro. Han ocurrido convulsiones a buceadores respirando una PO2 inspirada de tan solo 1,2 ATA, aunque estos casos generalmente están relacionados con circunstancias extenuantes (como condiciones médicas que predisponen el buceador a estas convulsiones). Por contra, buceadores profesionales Europeos han respirado de forma rutinaria presiones parciales de oxígeno de hasta 1,9 ATA bajo el agua, y los servicios de cámaras hiperbáricas exponen regularmente a sus pacientes a 2,8 ATA de oxígeno (o más) sin problemas. En medio de estas ambigüedades, dos tendencias parecen muy consistentes. La primera es que un alto nivel de ejercicio ( quizás más concretamente, un alto nivel de CO2 en la sangre) parece aumentar la probabilidad de sufrir convulsiones. En segundo lugar, los buceadores sumergidos bajo el agua tienen una tolerancia menor a concentraciones altas de oxígeno inspirado que las personas que se mantenienen en seco en una cámara hiperbárica o en un habitáculo submarino. (esto dejando aparte que un buceador en un hábitat seco tiene muchas más probabilidades de sobrevivir a las convulsiones que un buceador sumergido bajo el agua). Otra ineludible realidad relacionada con la toxicidad por oxígeno es el alto nivel de variabilidad tanto entre individuos, como en un mismo individuo.
Sumergidos bajo el agua, muchos buceadores consideran una PO2 de 1,4 ATA un límite máximo de seguridad durante periodos de ejercicio físico, y de 1,6 ATA durante periodos relajamiento.
El ochenta por ciento de las moléculas de gas del aire son de nitrógeno (N2). Nuestros cuerpos no necesitan ni tampoco usan el nitrógeno para el metabolismo, por lo tanto sirve de poco en las mezclas de gases que se respiran, aparte de diluir la concentración de oxígeno. Sin embargo, cuando altas concentraciones de nitrógeno se disuelven en nuestros cuerpos, el nitrógeno puede afectar nuestro sistema nervioso central. Conocido por todos los buceadores este es el efecto conocido como "narcosis por nitrógeno". Cousteau lo llamaba el "rapto de las profundidades", y sus efectos han sido comparados con la embriaguez por alcohol. Respirado a altas concentraciones, el nitrógeno puede perjudicar nuestras habilidades neurológicas. La bioquímica exacta es desconocida, pero los síntomas incluyen perdida de juicio, perdida de memoria a corto plazo, respuestas ralentizadas, y algunas veces euforia. Obviamente, igual que uno no debe conducir cuando está intoxicado, bucear con las facultades mentales disminuidas es por lo menos imprudente. Como en la toxicidad por oxígeno, hay un alto grado de variación en la susceptibilidad a la narcosis por nitrógeno tanto entre individuos, como en un mismo individuo. Existe alguna evidencia de que exposiciones continuadas pueden llegar a provocar un efecto de "adaptación", pero esto es un tema que está sujeto a continuos debates. Algunos buceadores empiezan a notar sus síntomas respirando aire a tan solo unos 27 metros (90 pies), mientras otros afirman no tener incapacitación alguna a profundidades superiores a los 61 metros ( 200 pies). Probablemente ocurren desajustes a niveles de PN2 inferiores a los que el buceador empieza a detectar síntomas evidentes. En cualquier caso, a mayor PN2 inspirada, más severa es la narcosis. Hay alguna evidencia de que el oxígeno también contribuye a la narcosis, pero probablemente solo a concentraciones superiores a las que la toxicidad por oxígeno CNS se convierte en principal problema.
El nitrógeno juega otro papel importante en la limitación del buceo convencional: su relación con la enfermedad de descompresión. Esto será tratado más detalladamente en la sección siguiente dedicada a la descompresión.
"What it all boils down to, is that no one's really got it figured out just yet."
- Alanis Morissette
El mal conocido como la Enfermedad Descompresiva, o más habitualmente, los "bends", ha sido bien documentada durante muchos años. Empezando con los trabajadores iniciales de los "caisson" construyendo puentes en cámaras presurizadas, se evidenció enseguida que si las personas respiraban gas comprimido a altas presiones durante un cierto tiempo, y luego volvían a la presión normal a nivel del mar, aparecían una amplia variedad de síntomas (incluyendo fatiga, dolores en las articulaciones de suaves a fuertes, erupciones y picores, vértigo, nauseas, desorientación, insensibilidad al tacto, parálisis de suaves a fuertes, perdida de la visión o de la audición, inconsciencia, e incluso la muerte). La U.S. Navy y otras organizaciones dedicaron mucho tiempo y muchos recursos a realizar experimentos con el objetivo de comprender mejor el proceso fisiológico relacionado con estos misteriosos síntomas. Pronto se aprendió tanto por la teoría como por los datos experimentales que disminuyendo la velocidad de ascenso de vuelta a la presión de superficie después de exponerse a altas presiones, los síntomas podían ser reducidos o eliminados. Una serie de "tablas de descompresión" -- planes que describen patrones de ascenso lentos y escalonados para volver a la superficie después de exposiciones a distintas profundidades durante distintos periodos de tiempo ( un proceso llamado "descompresión") -- fueron finalmente accesibles para el buceo deportivo en general. Desafortunadamente, por "conservadores" que fueran estos planes, no era perfectos. En muchos casos, personas que seguían estos planes padecían los síntomas de la enfermedad de descompresión. Y además, un gran número de inmersiones que seguían patrones de ascenso mucho menos conservadores que los planes propuestos, no padecían ningún síntoma de descompresión. Estaba claro que debía haber muchos otros factores para la "tema" de la descompresión que no fueran tan solo la profundidad y el tiempo. Entonces empezó un esfuerzo largo y continuo para entender todos los factores relacionados, y crear un modelo matemático que pudiera predecir mejor los patrones óptimos de ascenso (e.d., planes de descompresión). Como ha quedado claro, esto es un reto extremadamente difícil.
Si le preguntas por la calle a cualquier persona que no bucee que ocurre realmente en el interior del cuerpo de un buceador durante la enfermedad de la descompresión, la respuesta será probablemente "No lo sé".
Si le haces la misma pregunta a un instructor de buceo cualquiera, la respuesta será probablemente que el nitrógeno es absorbido por el cuerpo estando bajo presión (como resultado de la Ley de Henry); y que si el buceador asciende demasiado rápido, el exceso de nitrógeno disuelto en la sangre "se saldrá de la solución" para formar pequeñas burbujas en la sangre; y que estas burbujas bloquearan el flujo de la sangre en ciertos tejidos, provocando todo tipo de estragos.
Plantéale la pregunta a un experto en medicina hiperbárica con experiencia y probablemente te dará una explicación de como las "microburbujas" que existen en nuestra sangre incluso antes de sumergirnos bajo el agua, y las proporciones las presiones parciales del gas dentro de estas burbujas en relación con las presiones parciales disueltas en la sangre circundante ( junto con una amplia variedad de otros factores) determinan si estas burbujas aumentarán y hasta que tamaño aumentarán; y que si aumentan lo suficiente, pueden dañar las paredes de los vasos sanguíneos, que a su vez provoca una compleja cascada de procesos bioquímicos llamados el "sistema del complemento" que conduce a la coagulación de la sangre alrededor de las burbujas y en los lugares en que están dañados los vasos sanguíneos; y que estos coágulos bloquearán el flujo sanguíneo en ciertos tejidos, provocando todo tipo de estragos. Probablemente leerás en el futuro que la enfermedad de descompresión es un fenómeno impredecible, y que un "modelo perfecto" para calcular los planes de descompresión no existirá nunca, y que por tanto la mejor manera de calcular el mejor plan de descompresión es examinando lo estructura de las probabilidades generadas por multitud de estadísticas de inmersiones.
Sin embargo, si buscas a los estudiosos con más conocimiento en el mundo sobre la descompresión y de la enfermedad de la descompresión, las 5 o 6 personas con más conocimiento y experiencia en este tema, los que realmente saben de lo que están hablando; la respuesta a la pregunta de cual es la causa de la enfermedad de la descompresión será invariablemente: "No lo se". Como puede verse, una persona cualquiera de la calle que no sea buceadora tiene aparentemente la mejor respuesta.
Lo que sigue una basta descripción de lo que parece ocurrir, y lo que pensamos que puede tener algo que ver con lo que causa de la enfermedad de la descompresión.
Podemos asumir probablemente que la Ley de Henry describe razonablemente bien la naturaleza de como los gases se disuelven en nuestra sangre. A partir de ahí, sin embargo, las cosa empiezan a complicarse. Par empezar, las reglas que son aplicables al oxígeno son diferentes a las reglas que se aplican a otros gases. Buena parte del oxígeno que se disuelve en nuestra sangre es inmediatamente capturado por la hemoglobina, la importante biomolécula que transporta el super-importante oxígeno a través de nuestro cuerpo. Además, el oxígeno es constantemente consumido por el metabolismo, por esto las concentraciones disueltas son siempre algo menores a las concentraciones inspiradas. Está generalmente aceptado por los especialistas en buceo que el oxígeno no necesita en general ser considerado en la descompresión y la enfermedad de la descompresión, por lo menos mientras la PO2 inspirada se mantiene dentro de los límites de seguridad de la toxicidad por oxígeno del CNS. Si uno podría respirar o no 100% de oxígeno a grandes profundidades sin riesgos de padecer la enfermedad de la descompresión es opinable, porque en realidad el riesgo de la toxicidad por oxígeno obliga a que las inmersiones a profundidades superiores a los 6 metros (20 pies) se hagan con mezclas que contengan otros gases adicionales distintas al oxígeno puro. Para el propósito de esta explicación sobre descompresión, solo consideraremos los otros gases de la mezcla que se respira dejando aparte el oxígeno.
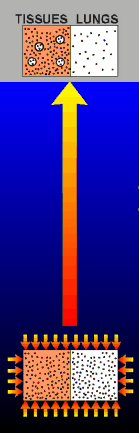 La mayoría de los
de los buceadores respiran aire bajo el agua. Tal como ya
se ha dicho, esto resulta en un aumento de la concentración del
nitrógeno disuelto en la sangre y en los tejidos del buceador. Si un
buceador permanece suficiente tiempo a suficiente profundidad, ek
buceador tendrá en la sangre y los tejidos una concentración
elevada de nitrógeno disuelto. Estas moléculas de nitrógeno
son "mantenidas" en solución en la
sangre por la presión ambiente que actúa sobre el cuerpo del buceador
a esta profundidad ( representado en la parte baja de la figura de la
izquierda). Si el buceador ascendiera bruscamente a la superficie,
la presión que "mantenía" el nitrógeno en solución será
drásticamente reducida. En esta situación, las moléculas de
nitrógeno o bien formarán burbujas, o (más probablemente)
provocarán que las pequeñas "microburbujas" pre-existentes
e inofensivas de la sangre crezcan lo suficiente como para causar problemas.
Tanto si estas burbujas causan daño directamente al bloquear el flujo de
la sangre en los capilares, como si lo causan al formar coágulos a través del
sistema del complemento, parece prácticamente seguro que la burbujas
son lo que finalmente provoca la enfermedad de la descompresión.
La mayoría de los
de los buceadores respiran aire bajo el agua. Tal como ya
se ha dicho, esto resulta en un aumento de la concentración del
nitrógeno disuelto en la sangre y en los tejidos del buceador. Si un
buceador permanece suficiente tiempo a suficiente profundidad, ek
buceador tendrá en la sangre y los tejidos una concentración
elevada de nitrógeno disuelto. Estas moléculas de nitrógeno
son "mantenidas" en solución en la
sangre por la presión ambiente que actúa sobre el cuerpo del buceador
a esta profundidad ( representado en la parte baja de la figura de la
izquierda). Si el buceador ascendiera bruscamente a la superficie,
la presión que "mantenía" el nitrógeno en solución será
drásticamente reducida. En esta situación, las moléculas de
nitrógeno o bien formarán burbujas, o (más probablemente)
provocarán que las pequeñas "microburbujas" pre-existentes
e inofensivas de la sangre crezcan lo suficiente como para causar problemas.
Tanto si estas burbujas causan daño directamente al bloquear el flujo de
la sangre en los capilares, como si lo causan al formar coágulos a través del
sistema del complemento, parece prácticamente seguro que la burbujas
son lo que finalmente provoca la enfermedad de la descompresión.
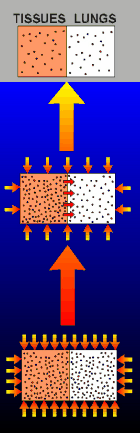 La solución para evitar
la enfermedad de la descompresión, es por lo tanto, evitar la
formación y/o crecimiento de las burbujas. El nitrógeno no
"rellena" instantáneamente el cuerpo de un buceador. El
proceso de la difusión del nitrógeno en la sangre y en los tejidos
lleva algún tiempo. Si un buceador permanece a poca profunda, puede ascender
en general directamente a la superficie sin experimentar síntomas de la enfermedad
de la descompresión. Este tipo de inmersiones se llaman inmersiones
"sin-descompresión". Sin embargo, cuando los buceadores permanecen a una
profundidad y durante un tiempo suficientes, bastante nitrógeno se disuelve en
la sangre y en los tejidos para
que una vuelta directa a la superficie les sitúe con una alta
probabilidad de sufrir síntomas de la enfermedad de descompresión.
Cuando se asciende en este tipo de inmersiones, los buceadores deben
permanecer un tiempo a cotas poco profundas para permitir escapar el exceso de
gas disuelto. A esto se le llama "Descompresión", y está
representado en la figura de la derecha.
La solución para evitar
la enfermedad de la descompresión, es por lo tanto, evitar la
formación y/o crecimiento de las burbujas. El nitrógeno no
"rellena" instantáneamente el cuerpo de un buceador. El
proceso de la difusión del nitrógeno en la sangre y en los tejidos
lleva algún tiempo. Si un buceador permanece a poca profunda, puede ascender
en general directamente a la superficie sin experimentar síntomas de la enfermedad
de la descompresión. Este tipo de inmersiones se llaman inmersiones
"sin-descompresión". Sin embargo, cuando los buceadores permanecen a una
profundidad y durante un tiempo suficientes, bastante nitrógeno se disuelve en
la sangre y en los tejidos para
que una vuelta directa a la superficie les sitúe con una alta
probabilidad de sufrir síntomas de la enfermedad de descompresión.
Cuando se asciende en este tipo de inmersiones, los buceadores deben
permanecer un tiempo a cotas poco profundas para permitir escapar el exceso de
gas disuelto. A esto se le llama "Descompresión", y está
representado en la figura de la derecha.
Al ascender el buceador la presión ambiente empieza a disminuir. Esto significa que la presión del gas en los pulmones ( y por lo tanto la presión parcial del nitrógeno en los pulmones) también disminuirá. En este punto actua la Ley de Henry invertida: las moléculas de nitrógeno pasarán de la sangre y de los tejidos a los pulmones, y serán expulsados del buceador con la expiración. La profundidad a la que se realiza esta descompresión es crítica: debe ser lo suficientemente poco profunda para que la PN2 en los pulmones sea inferior a la concentración de nitrógeno disuelto en la sangre, pero lo suficientemente profunda para que la presión ambiente sea suficiente para evitar el crecimiento significativo de burbujas. Generalmente la descompresión se realiza por "escalones" -- a intervalos de 3 metros (10 pies). Esto permite al buceador volver a la superficie por etapas, permitiendo al nitrógeno disuelto excesivo escapar del cuerpo.
Hay que señalar que, aunque un buceador al volver a la superficie de una inmersión "sin-descompresión" no experimente generalmente síntomas de la enfermedad de descompresión, no significa que no se formen o crezcan burbujas en la sangre. Solo significa que las burbujas no crecen lo suficiente para causar síntomas obvios. Pueden incluso ocurrir daños en ausencia de síntomas, por lo tanto los buceadores son instados a alargar el tiempo de vuelta a la superficie, incluso en el caso de una inmersión "sin-descompresión". Esta práctica se llama "paradas de descompresión de seguridad" o simplemente "paradas de seguridad".
El tema de la descompresión es mucho, mucho más complicado que esto. Información adicional pude obtenerse de algunas de las referencias listadas más abajo bajo "Lecturas Adicionales"
Debido al problema asociado con la toxicidad del oxígeno, la narcosis del nitrógeno, y el mal de la descompresión, el límite máximo de seguridad respirando aire es de 61 metros (200 pies) más o menos. Para superar estos problemas, deben usarse mezclas gaseosas distintas del aire. Quizás la más grave, y potencialmente mortal, de las limitaciones sea la toxicidad por oxígeno CNS. El aire contiene 21% de oxígeno aproximadamente. El límite máximo de seguridad de 1,4 ATA para la PO2 es excedido con aire a una presión ambiente de 7 ATA aproximadamente, o 60 metros (198 pies). La narcosis por nitrógeno a estas profundidades a sido equiparado al efecto de haber bebido varios Martinis; y, por cada minuto de permanencia respirando aire a esta profundidad, se requieren de 3 a 8 minutos aproximadamente para la descompresión.
El primer paso es resolver el problema de la toxicidad por oxígeno CNS. Esto es de hecho relativamente sencillo: para aumentar la profundidad a la que se alcanza el límite de 1,4 ATA de PO2 , solo tenemos que reducir la fracción de oxígeno en el gas que se respira. Por ejemplo, una mezcla conteniendo solo 10% de oxígeno alcanzará una PO2 de 1,4 ATA cuando la presión ambiente sea de 14 ATA - sobre los 130 metros (433 pies) de profundidad! El problema, sin embargo, es que si el oxígeno eliminado fuera reemplazado por nitrógeno, los efectos de la narcosis por nitrógeno aumentarían. Por lo tanto, para extender la profundidad máxima de seguridad en inmersión, tanto el oxígeno como el nitrógeno deben ser reducidos. La única forma de conseguir esto es introduciendo otro componente en la mezcla de gases a respirar. Este componente es generalmente el helio.
El helio tiene dos ventajas fundamentales sobre el nitrógeno para mezclas para respirar en buceo profundo. La primera ventaja es que no causa narcosis, incluso a presiones parciales inspiradas muy altas. la segunda ventaja es que es una molécula mucho más pequeña, y por tanto el helio es mucho menos denso. Debido a que las moléculas están densamente ajuntadas bajo altas presiones, la densidad del gas aumenta. Para moléculas relativamente grandes, este aumento en la densidad puede provocar un incremento en el esfuerzo necesario para respirar. El helio es menos denso a 91 metros (300 pies) que el nitrógeno a nivel del mar. Estas dos ventajas hacen que el helio sea el gas escogido para la mezcla de gases para respirar en profundidad.
Las mezclas con helio para respirar viene en general en dos formas: heliox -- helio y oxígeno sin nada de nitrógeno u otros componentes gaseosos; o trimix -- una combinación de tres gases, helio, oxígeno y generalmente nitrógeno. El heliox es más usado por los buceadores militares o comerciales, mientras el trimix es más usado por los buceadores "técnicos" civiles. Cada mezcla tiene sus ventajas y sus inconvenientes, pero ambas obtienen los mismos resultados básicos: reducir la concentración de oxígeno, reducir o eliminar el nitrógeno, y reducir la densidad global del gas.
Desafortunadamente, desde la perspectiva de la descompresión, el helio no es un gas ideal para los perfiles de inmersión que la mayoría de buceadores civiles profundos realiza (e.d., menos de una o dos horas a profundidad). Debido a su pequeñísimo tamaño molecular, el helio se disuelve en la sangre y los tejidos mucho más deprisa que el nitrógeno. Más helio disuelto en menos tiempo de buceo significa menor proporción de tiempo de buceo respecto al tiempo de descompresión. Si el heliox o el trimix fuera respirado a lo largo de toda la inmersión, incluyendo la descompresión, el tiempo de buceo total sería extremadamente largo. La proporción de tiempo de buceo respecto al tiempo de descompresión en inmersiones profundas con helio puede ser drásticamente aumentada si, durante el ascenso, la mezcla que se respira es cambiada por una que no contenga helio. Dado que la mayor parte del tiempo de descompresión transcurren a cotas relativamente poco profundas, la narcosis no es un problema, con lo que se puede utilizar aire.
Sin embargo, el aire tampoco es un gas ideal para la descompresión, porqué contiene mucho nitrógeno. Aunque el helio sale del cuerpo rápidamente cuando se realiza la descompresión respirando aire, el nitrógeno está entrando en la sangre y los tejidos simultáneamente. La cantidad de nitrógeno añadido al cuerpo puede reducirse disminuyendo la fracción de nitrógeno en la mezcla que se respira durante la descompresión. Como el oxígeno no contabiliza en la dinámica de la descompresión, el nitrógeno se puede reemplazar por oxígeno. Las mezclas compuestas solo de nitrógeno y oxígeno, con más de 21% de oxígeno, se conocen popularmente como nitrox. Cada vez más, los buceadores deportivos utilizan nitrox para inmersiones a profundidades moderadas, donde la toxicidad por oxígeno CNS no representa un problema, y donde los tiempos de descompresión pueden alargarse. Para el buceo profundo, el nitrox se utiliza para acelerar la descompresión. Mientras que el nitrox es útil para la descompresión a profundidades intermedias, el oxígeno puro se usa a profundidades de 6 metros (20 pies) o menos. Sin nada de nitrógeno o de helio, el oxígeno puro maximiza la proporción de descompresión, recortando drásticamente los tiempos de descompresión.
Por tanto, utilizando mezclas de gases distintas durante diferentes partes de la inmersión, los límites del buceo convencional pueden extenderse optimizándose la descompresión. Una gran cantidad de información adicional sobre este y otros temas relacionados está disponible en una multitud de variadas publicaciones, algunas de las cuales relacionamos a continuación. Los buceadores interesados en utilizar mezclas de gases para respirar distintas del aire son alentados a leer el máximo posible de información, y buscar la formación adecuada a las técnicas de buceo con mezclas de gases.
Lecturas Adicionales
Nota: Esta sección no está completa. Más adelante se añadirán referencias.
Bean, J.W. 1945. Effects of oxygen at increased pressure. Physiol. Rev. 25:1-147.
Bennett, P.B. 1982a. Inert gas narcosis. In: The Physiology and Medicine of Diving and Compressed Air Work. (P.B. Bennett and D.H. Elliot, eds), Balliere-Tindall, London. pp. 239-261.
Bennett, P.B. 1982b. The high pressure nervous syndrome in man. In: The Physiology and Medicine of Diving and Compressed Air Work. (P.B. Bennett and D.H. Elliot, eds), Balliere-Tindall, London. pp. 262-296.
Bennett, P.B. 1990. Inert gas narcosis and HPNS. In: Diving Medicine, Second Edition (A.A. Bove and J.C. Davis, eds.). W.B. Saunders Company, Philadelphia. pp. 69-81.
Bennett, P.B, R. Coggin, and J. Roby. 1981. Control of HPNS in humans during rapid compression with trimix to 650 m (2132 ft). Undersea Biomed. Res., 8(2): 85-100.
Bove, A.A. and J.M. Wells. 1990. Mixed gas diving. In: Diving Medicine, Second Edition (A.A. Bove and J.C. Davis, eds.). W.B. Saunders Company, Philadelphia. pp. 50-58.
Clark, J.M.. 1982. Oxygen toxicity. In: The Physiology and Medicine of Diving and Compressed Air Work. (P.B. Bennett and D.H. Elliot, eds), Balliere-Tindall, London. pp. 200-238.
Clark, J.M. and C.J. Lambertsen. 1971. Pulmonary oxygen toxicity: a review. Pharmacol. Rev. 23:37-133.
Hamilton, R.W. 1992a. Understanding special tables: Some things you should know. aquaCorps 3(1):28-31.
Hamilton, R.W. 1992b. Rethinking oxygen limits. technicalDIVER, v.3.2., pp. 16-19.
Hamilton, R.W. and J.T. Crea. 1993. Desktop decompression review. aquaCorps no. 6: 11-17.
Hamilton, R.W. and D.J. Kenyon. 1990. DCAP Plus: New concepts in decompression table research. In: MTS: Science and Technology for a New Ocean's Decade, Vol. 3., Marine Technology Society, Washington, D.C.
Kindwall, E.P. 1990. A short history of diving and diving medicine. In: Diving Medicine, Second Edition (A.A. Bove and J.C. Davis, eds.). W.B. Saunders Company, Philadelphia. pp. 1-8.
Lambertsen, C.J. 1978. Effects of hyperoxia on organs and their tissues. In: Extrapulmonary Manifestations of Respiratory Disease. Lung Biology in Health and Disease. Vol. 8. (E.D. Robin, ed.). Marcel Dekker, New York. pp. 239-303.
Lambertsen, C.J., J.M. Clark, R. Gelfand, et al. 1987. Definition of tolerance to continuous hyperoxia in man. An abstract report of Predictive Studies. In: Underwater and Hyperbaric Physiology IX (A.A. Bove, A.J. Bacherach, and L.J. Greenbaum, eds), Undersea and Hyperbaric Medical Society, Bethesda. pp. 717-735.
Menduno, M. 1992. Set theory: a look at rigging options. aquaCorps 3(1):22-23.
Mount, T. 1993. Chapter 13. Operational practices: Equipment configurations. In: Mixed Gas Diving: The Ultimate Challange for Technical Divers. (T. Mount and B. Gilliam, eds) Watersports Publishing, Inc., San Dieago, California. pp. 233-248.
Mount, T. and B. Gilliam (eds). 1993. Mixed Gas Diving: The Ultimate Challange for Technical Divers. Watersports Publishing, Inc., San Dieago, California. 392 pp.
National Oceanic and Atmospheric Administration (NOAA). 1991. NOAA Diving Manual: Diving for Science and Technology. Office of Undersea Research, National Oceanic and Atmospheric Administration, U.S. Department of Commerce, Washington, D.C.
Pyle, R.L. 1996. Section 7.9. Multiple gas mixture diving, Tri-mix. In: Flemming, N.C. and M.D. Max (Eds.) Scientific Diving: a general code of practice, Second Edition. United Nations Educational, Scientific and Cultural Organization (UNESCO), Paris; and Scientific Committee of the World Underwater Federation (CMAS), Paris, pp. 77-80.
Sharkey, P. and R.L. Pyle. 1992. The Twilight Zone: The potential, problems, and theory behind using mixed gas, surface-based scuba for research diving between 200 and 500 feet. In: Diving for Science...1992, proceedings of the American Academy of Underwater Sciences Twelfth Annual Scientific Diving Symposium. American Academy of Underwater Sciences, Costa Mesa, CA.
Stone, W.C. 1989a. Deep cave diving: Physiological factors. In: The Wakulla Springs Project (W.C. Stone, ed.), U.S. Deep Caving Team, Derwood, Maryland. pp. 25-53.
Stone, W.C. 1992. The case for heliox: a matter of narcosis and economics. aquaCorps 3(1):11-16.
Thom, S.R. and J.M. Clark. 1990. The toxicity of oxygen, carbon monoxide, and carbon dioxide. In: Diving Medicine, Second Edition (A.A. Bove and J.C. Davis, eds.). W.B. Saunders Company, Philadelphia. pp. 82-94.
Yarbrough, O.D., W. Welham, E.J. Brinton and A.R. Behnke. 1947. Symptoms of oxygen poisoning and limits of tolerance at rest and at work. Nav. Exp. Diving Unit Rep. 01-47.